■燃料電池
いよいよ燃料電池についてです。
燃料電池は水の電気分解と全く逆の反応をします。
・・・また言っちゃった。
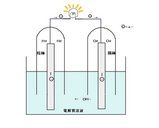
下の図を見て下さい。↓
【燃料電池の仕組み】
(クリックで拡大します。)
※燃料電池の場合、+極になる側を酸素極(陽極)、-極になる側を水素極(陰極)と
呼びます。
※電流は+から-へ流れますが、本質は、電子(e-)が-から+へ動いています。
電極に覆いをして水素と酸素がそれぞれ電極に溜まるようにします。
そして電球などをつないでやると、陰極ではH2と電解液中のOH-が反応して、H2Oと電子(e-)ができます。
H2 + 2OH- → 2H2O + 2e-
このとき電子が導線を移動して電球を光らせます。
陽極では陰極で発生した電子をもらって、酸素と水から水酸化物イオンができます。
H2O + 1/2 O2 + 2e- → 2OH-
つまり、電解液中のOH-が水素極に行き、H2と反応させて電子(e-)を発生させ、それが酸素極に移動するとき電球を光らせ、酸素極ではその電子を使って、酸素と水からOH-を作るのです。
この繰り返しで電流が流れていきます。
上の化学式からe-を消去すると
H2 + 1/2 O2 → H2O
となり、これを2倍して
2H2 + O2 → 2H2O
となります。
水の電気分解と全く逆の反応ということが分かります。
( 2H2O → 2H2 + O2 : 水の電気分解)
これが燃料電池は水の電気分解の逆の反応といわれる訳です。
※電解液の性質によってはOH-の代わりにH+が電極間を移動するタイプのものもあります。
最近ではこのタイプのものが主流になってきているようです。
H+が移動する場合、
陰極 : H2 → 2H+ + 2e-
陽極 : 1/2 O2 + 2H+ + 2e- → H2O
となります。
※また、電解液を使う代わりに電解膜を使用するタイプもあります。この膜の耐久性によって、燃料電池の性能が決まると言っても過言ではありません。